Uso de plasma rico em plaquetas no reparo do manguito rotador
Um Estudo Randomizado Prospectivo do Uso de plasma rico em plaquetas no reparo do manguito rotador realizado por Eduardo Angeli Malavolta, PhD, Dr. Mauro Emilio Conforto Gracitelli, Arnaldo Amado Ferreira Neto, PhD, Dr. Jorge Henrique Assunção, Dr. Marcelo Bordalo-Rodrigues, e Olavo Pires de Camargo, PhD, investigação realizada no Instituto de Ortopedia e Traumatologia da faculdade de Medicina da Universidade de São Paulo, São Paulo, Brasil.
Histórico: Embora o Plasma Rico em Plaquetas (PRP) já tenha sido usado em reparos do manguito rotador, a maior parte dos autores não tiveram sucesso em relatar as vantagens deste método em estudos clínicos.
Hipótese: O uso de PRP proporciona melhores resultados estruturais e funcionais na Reparação Artroscópica do Manguito Rotador.
Concepção do Estudo: Estudo randomizado controlado; Nível de evidência, 1.
Métodos: Este foi um estudo prospectivo, randomizado, duplo-cego que contou com dois grupos de 27 pacientes cada (Grupo PRP e Grupo Controle). Lesões do supraespinhal completas com retração de menos de 3 cm foram submetidas à reparo artroscópico em fileira simples. Ao fim do procedimento cirúrgico, PRP líquido foi preparado por aférese e administrado aos pacientes do grupo PRP com trombina autóloga. Os resultados foram avaliados pela Universidade da Califórnia em Los Angeles (UCLA) e através da Escala Constant, escala visual analógica (VAS) para dor, imagem de ressonância magnética (RM) antes e nos meses 3, 6, 12 e 24 após a cirurgia. O nível de significância foi de 5%.
Resultados: Os 2 grupos de pacientes apresentaram melhora clínica significativa (P<.001). Entre a avaliação pré-operatória e a consulta final aos 24 meses do acompanhamento, a média da pontuação UCLA aumentou de 13,63 ± 3,639 para 32,70 ± 3,635, no grupo controle, e de 13,93 ± 4.649 para 32,44 ± 4.318 no grupo PRP (P = .916). A média na pontuação Constant aumentou de 47,37 ± 11,088 para 85,15 ± 9,879 no grupo controle e de 46,96 ± 11,937 para 84,78 ± 14,048 no grupo PRP (P = .498). A pontuação média do VAS variou de 7,00 ± 1,939 e 6,67 ± 1,617 antes da cirurgia para 1,15 ± 1,916 e 0,96 ± 2,224 na avaliação de 24 meses nos grupos controle e PRP, em respectivo (P = .418). A única diferença foi na pontuação UCLA média aos 12 meses. 30,04 ± 4,528 no grupo controle e 32,30 ± 3,506 no grupo PRP (P = .046). O grupo controle trouxe um caso de ruptura completa e quatro casos de rupturas parciais, e o grupo PRP trouxe dois casos de rupturas parciais (P = .42).
Conclusão: O plasma rico em plaquetas, preparado por aférese e aplicado no estado líquido com trombina, não favoreceu melhores resultados clínicos quando avaliados na consulta de revisão de 24 meses. Tendo em conta os números disponíveis para análise, a taxa de reincidência também não se alterou.
Palavras-chave: plasma rico em plaquetas; reparo do manguito rotador; cirurgia artroscópica
Uso de plasma rico em plaquetas no reparo do manguito rotador
A prevalência de lesão no manguito rotador é de 20,7% na população total e sobe para 50% entre os pacientes com mais de 80 anos. Embora o reparo artroscópico do manguito rotador esteja associado a uma melhora funcional significativa, a taxa de reincidência varia entre 8% e 94%.
A cicatrização deficiente entre tendões e ossos é considerada causa relevante de reincidência da lesão após a reparação, o manguito rotador não recupera seus traços histológicos originais, mas sua fixação envolve a formação de tecido cicatricial que exibe menos força biomecânica. O plasma rico em plaquetas (PRP) foi utilizado no tratamento das lacerações do manguito rotador para melhorar os resultados clínicos e alterar a taxa de reincidência. É um volume de plasma autólogo que exibe uma concentração plaquetária acima do nível basal e é rico em fatores de crescimento. Existem dois métodos para preparar PRP: aférese e centrifugação. Embora este último produza PRP de uma forma mais prática e menos dispendiosa, o primeiro produz concentrações plaquetárias significativamente mais elevadas.
Até esta data, 12 estudos comparativos avaliaram o efeito do PRP no reparo do manguito rotador, dos quais 8 foram estudos randomizados. Foi relatado que o plasma rico em plaquetas induz resultados funcionais tanto melhores como mais pobres. Os resultados favoráveis e desfavoráveis também foram relatados em relação à integridade estrutural dos tendões, e ainda não há um consenso sobre a eficácia do uso do PRP. Duas revisões sistemáticas com metanálises não mostraram diferenças clínicas entre o grupo PRP e o grupo controle, mas demonstraram uma menor reincidência nos casos de lacerações pequenas e médias quando usado o método PRP. Três estudos avaliaram o PRP preparado por aférese, e apenas um foi randomizado. O objetivo do presente estudo era avaliar o efeito do PRP ativado pela trombina preparado por aférese em um reparo artroscópico de lesões pequenas e médias do supraespinhal.
MATERIAIS E MÉTODOS
Concepção do Estudo
Conduzimos um estudo clínico terapêutico, paralelo, randomizado 1:1, prospectivo, em um único centro, com mascaramento tanto em relação aos participantes como aos examinadores. O estudo foi aprovado pelo Comitê de Ética de Pesquisa local. O estudo foi registrado e aprovado pelos Institutos Nacionais de saúde (ClinicalTrials.gov identificador: NCT01029574).
Participantes
Os critérios de inclusão foram os seguintes: roturas do supraespinhal completas confirmadas por exames de ressonância magnética (RM) sem histórico de trauma, e retração de menos de 3 cm. Casos com lesões em outros tendões, degeneração gordurosa(grau 3 na scala Fuchs), artrose glenoumeral, cirugia no ombro prévia, patologias psiquiátricas ou reumatológicas, fibromialgia, ou contagem de plaquetas menor de 150,000/mm³ foram excluídos. Os participantes também eram excluídos caso os seguintes itens fossem observados durante a cirurgia: lesão do subescapular com necessidade de reparo, rotura do infraespinhal, rotura não totalmente reparável, ou a necessidade de se converter o procedimento para uma cirurgia aberta.
Preparação PRP
O plasma rico em plaquetas foi preparado após a aplicação da anestesia para garantir o mascaramento adequado. O separador de células sanguíneas MCS1 9000 e o conjunto de aférese 994-CFE (Haemonetics Corp) foram utilizados para preparar o PRP. Aproximadamente 400 ml de sangue foi direcionado através do acesso periférico ao dispositivo contínuo de separação das células sanguíneas a 5800 RPM por 15 minutos. O citrato de sódio (10%) foi utilizado como anticoagulante. O dispositivo utilizado no presente estudo pode separar cerca 40 ml de PRP. Plasma pobre em plaquetas (cerca de 360 ml) foi restituído aos participantes através do mesmo acesso periférico. A trombina autóloga foi preparada utilizando 10 ml de PRP e 0,4 ml de cloreto de cálcio a 10%. Após a formação do gel, recolheu-se o supernatante rico em trombina. O material necessário para a posterior aplicação de PRP ativado foi colocado em seringas: duas alíquotas de 10 ml de PRP, bem como 2 frações de trombina e 10% de cloreto de cálcio (1,5 e 0,8 ml, em respectivo).
Procedimento cirúrgico
O mesmo cirurgião realizou todos os 54 procedimentos cirúrgicos. A cirurgia foi realizada com os participantes na posição de “cadeira de praia” sob anestesia geral e bloqueio interescalênico. Uma acromioplastia foi realizada em todos os casos, assim como o desbridamento sem decorticação do tubérculo maior Um reparo em fileira simples foi realizado com âncoras de sutura duplamente carregadas (Twinfix, Smith & Nephew Endoscopy) e pontos simples. O número de âncoras e a necessidade de suturas látero-laterais adicionais foram decididos na cirurgia. Procedimentos no tendão do bíceps foram realizados em casos com lacerações parciais, subluxação e luxação completa. Foi realizada tenotomia em pacientes com mais de 60 anos e tenodese nos mais jovens. Sempre que necessário, a tenodese do bíceps foi realizada com uma das âncoras de sutura anterior acima do manguito rotador.
Aplicação PRP
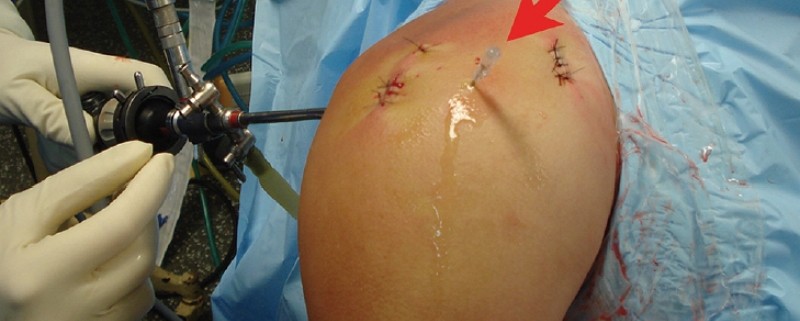
No grupo PRP, os portais artroscópicos foram suturados após o fim do procedimento cirúrgico, com exceção do portal posterior, que foi deixado aberto para proporcionar visibilidade. Um cateter intravenoso 14G Jelco foi introduzido através de uma área coberta por pele intacta, ou seja, não através de qualquer portal. O local de entrada da agulha estava localizado entre os portais anterior e lateral (Figura 1).

O local de entrada da agulha estava localizado entre os portais anterior e lateral (Figura 1)
A agulha foi colocada na interface tendão-osso. (Figura 2).
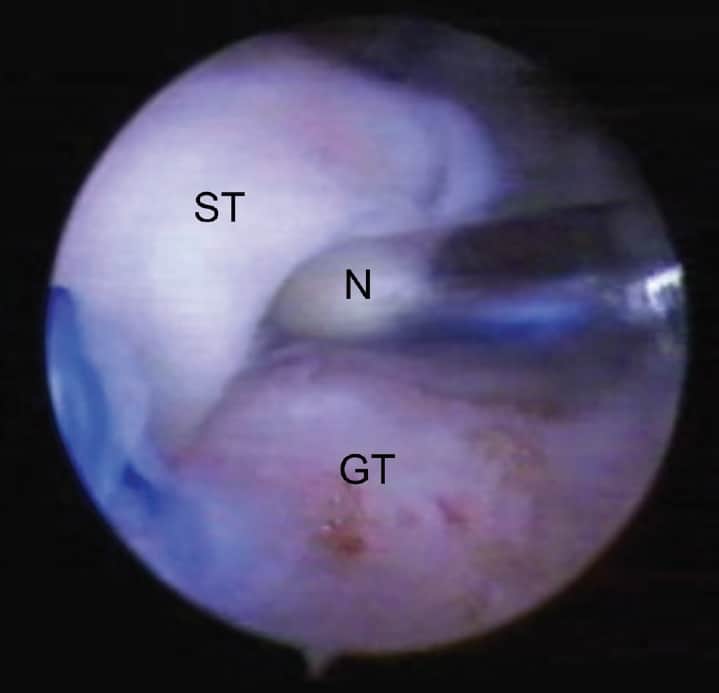
A agulha foi colocada na interface tendão-osso. (Figura 2).
Em seguida, a infusão da solução salina normal foi interrompida e o fluido remanescente no espaço subacromial foi aspirado. Em seguida, o concentrado de plaquetas foi aplicado. Dez mililitros do PRP colhido foram misturados com 1,5 ml da trombina autóloga previamente preparada e 0,8 ml de cloreto de cálcio a 10% e injetados na forma líquida através da agulha posicionada como descrito acima. Um volume total de 24,6 ml foi aplicado, incluindo 20 ml de PRP, 3 ml de trombina e 1,6 ml de cloreto de cálcio. Um assistente bloqueou os portais suturados com os dedos para minimizar o vazamento do material injetado. A técnica utilizada no presente estudo para aplicar o PRP foi baseada em Randelli et al. O assistente cessou o bloqueio dos portais 5 minutos após a aplicação do PRP. Enfim, o portal posterior foi fechado através da mesma técnica usada anteriormente.
Reabilitação
A terapia analgésica foi padronizada para todos os pacientes. Durante a estada no hospital, os participantes receberam medicação intravenosa composta por 1 agente analgésico (2g de dipirona a cada 6 horas), 1 anti-inflamatório não esteroide (AINEs) (100 mg de cetoprofeno a cada 12 horas), e 1 agente analgésico opioide (100 mg de tramadol a cada 8 horas). Após a alta, a medicação foi prescrita por via oral, sendo composta por 1 AINE (200 mg de celecoxib de 12 em 12 horas) e 1 analgésico (500 mg de acetaminofeno de 6 em 6 horas) de modo contínuo e 1 analgésico opioide (30 mg de codeína de 6 em 6 horas) para ser tomado em caso de dor muito grave. A terapia analgésica padrão foi indicada para os primeiros 7 dias e após esse período modificada de forma individual. O ombro ficou imobilizado durante 6 semanas. Nenhum movimento foi permitido durante as primeiras 3 semanas. Exercícios passivos foram permitido depois. Exercícios ativos livres e ativos assistidos foram iniciados após a semana 6, quando o uso da tipoia foi descontinuado. O fortalecimento muscular foi iniciado na semana 12.
Resultados
A avaliação funcional medida pela escala de classificação dos ombros da Universidade da Califórnia em Los Angeles (UCLA) foi estabelecida como desfecho primário. Os desfechos secundários incluíram a avaliação funcional de acordo com a escala Constant do ombro, a dor foi medida pela escala analógica visual (VAS) e a taxa de reincidência avaliada por exames de RM. Todas as análises clínicas foram realizadas antes da cirurgia e nos meses 3, 6, 12 e 24 depois. Além disso, a pontuação VAS foi obtida nos dias 1 e 7. O número de complicações também foi avaliado. As imagens de ressonância magnética foram obtidas em um equipamento de 1.5T (Signa HDxT, GE Healthcare) com uma bobina específica para o ombro. O protocolo para obtenção das imagens do ombro incluíam varredura coronal oblíqua para obtenção da densidade de prótons (tempo de repetição / tempo de eco [TR/TE], 2800/38 ms; campo de visão [FOV], 14 cm; espessura do corte, 3,5 mm; espaço de 0,4 mm; matriz de 320 x 256); imagens ponderadas em T2 em cortes sagitais oblíquos com supressão de gordura, coronais oblíquos, e axiais (TR/TE, 3400/50; FOV, 14 cm; espessura do corte, 3,5 mm; espaço de 0,4 mm; matriz 256 x 256); e imagens sagitais oblíquas ponderadas em T1 (TR/TE, 780/15; FOV, 14 cm; espessura do corte, 3,5 mm; espaço de 0,4 mm; matriz 320 x 256). Não foi utilizado gadolínio intra-articular nem intravenoso em nenhum dos exames. As imagens foram analisadas por um radiologista musculoesquelético com 12 anos de experiência. Os exames de ressonância magnética foram direcionados para analisar o estado do tendão de acordo com a classificação Sugaya. Além disso, comparou-se a incidência de rupturas completas e a taxa global de reincidências (soma de reincidências parciais e completas). A ressonância magnética foi realizada antes da cirurgia e nos meses 3, 6 e 12 depois.
Tamanho da Amostra
O tamanho da amostra foi calculado com base na pontuação UCLA. Com base no conceito de diferença de importância clínica mínima, os resultados para o grupo PRP deveriam ser superiores em 2 pontos quando comparados com o grupo controle. Seguindo Sugaya et al., o DP foi estabelecido como 3,7 nesse cálculo. Com 80% do poder estatístico, e um nível de significância (bilateral) de 5%, provou-se serem necessários 54 participantes (27 em cada grupo).
Randomização
A alocação dos participantes foi formulada por uma estratégia simples de randomização através de uma ferramenta disponível em http:// www.random.org/coins/. Os participantes do estudo foram distribuídos de forma aleatória por um médico não envolvido no estudo. Os resultados da distribuição aleatória foram mantidos em envelopes selados, e foram anexados aos registros clínicos dos pacientes. Os envelopes só foram abertos no momento da cirurgia, após o participante ter sido anestesiado.
Mascaramento
O fisioterapeuta que realizou a avaliação funcional, os fisioterapeutas envolvidos durante a fase de reabilitação, o radiologista que realizou a análise das imagens de ressonância magnética, os participantes, e o estatístico estavam todos alheios acerca do grupo que cada participante pertencia.
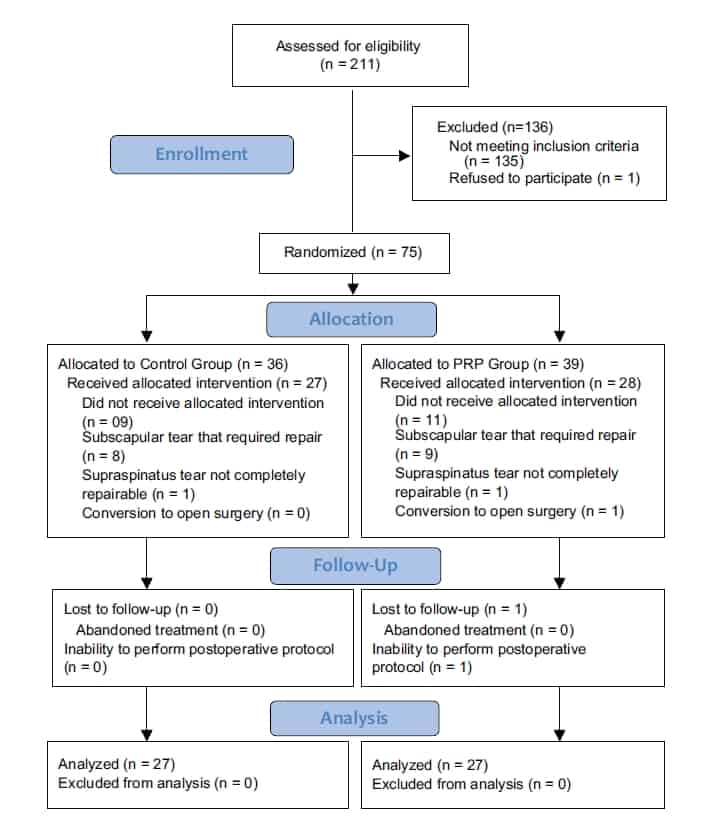
Figura 3 – Fluxograma dos participantes
Análise estatística
Os parâmetros clínicos aos 24 meses foram analisados pelo teste de Mann-Whitney. Um teste t de Student de medidas repetidas foi usado para comparar os grupos de acordo com as pontuações UCLA, de Constant e VAS em outros momentos. O teste de Friedman foi usado para realizar a análise post hoc. Os resultados da ressonância magnética pós-operatória foram analisados pelo teste exato de Fisher ou pelo teste de χ². O nível de significância foi estabelecido como P < .05. Não foi utilizado nenhum método de imputação para os dados faltantes, e todos os participantes completaram o período de acompanhamento pós-cirúrgico. Uma análise por intenção de tratar foi realizada. A análise estatística foi realizada usando o software SPSS versão 20.0 (SPSS Inc).
RESULTADOS
Fluxograma de Participantes
Um total de 211 pacientes foram avaliados por nós, entre setembro de 2008 e abril de 2012, quanto à sua elegibilidade para o presente estudo. Um total de 135 participantes não cumpriram os critérios de inclusão, e 1 recusou-se a participar. Portanto, 75 participantes foram submetidos à randomização.
20 participantes foram excluídos: durante a cirurgia foram encontradas lesões subescapulares em 17 dos participantes, o tendão não foi reparado por completo em 2 dos casos, e a conversão para cirurgia aberta precisou ser feita em uma das ocasiões. Outro participante foi excluído durante o período de acompanhamento pós-cirúrgico por mostrar-se incapaz de seguir os protocolos pós-operatórios (cirurgia intracraniana no 15º dia do pós-operatório). Assim, foram analisados os dados de 54 participantes, com 27 participantes em cada grupo. A figura 3 apresenta um fluxograma que representa os participantes incluídos no estudo.
Dados de Referência
Os parâmetros de referência dos participantes nos grupos foram comparados, e os resultados são descritos nas Tabelas 1 e 2. Nenhuma variável investigada exibiu diferenças significativas.
Avaliação Clínica
Pontuação UCLA: A média UCLA pré-operatória foi de 13,63 ± 3,639 no grupo controle e 13,93 ± 4,649 no grupo PRP, sem diferenças de significância estatística (P = .795). Nenhuma das avaliações, aos 3 e aos 6 meses, produziu diferenças de significância estatística (P = .356 and .288, em respectivo).
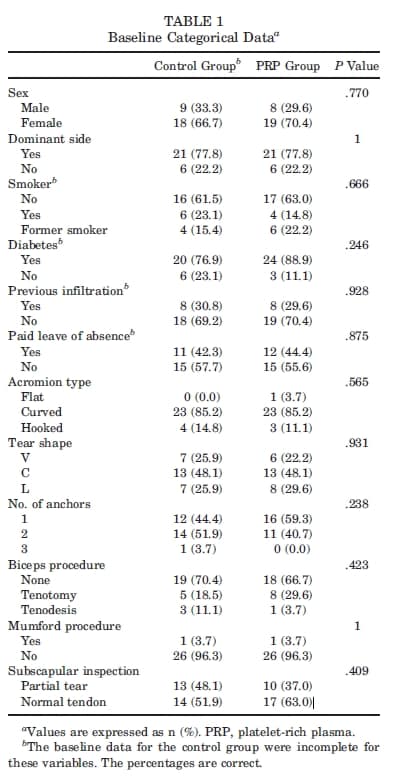
Tabela 1
Aos 12 meses, as pontuações médias dos grupos controle e PRP foram de 30,04 ± 4,528 e 32,30 ± 3,506, respectivamente; esta diferença teve significância estatística (P = .046). Aos 24 meses, as pontuações médias foram de 32,70 ± 3,635 no grupo controle e 32,44 ± 4,318 no grupo PRP, sem diferença significativa (P = .916). Os dados correspondentes são descritos na Tabela 3. O teste de Friedman revelou que ambos os grupos exibiram melhoras significativas ao longo do tempo de acompanhamento pós-cirúrgico (P < .001).
Pontuação de Constant: Os valores médios da pontuação de Constant no pré-operatórios foram de 47,37 ± 11,088 no grupo controle e 46,96 ± 11,937 no grupo PRP, sem diferenças de significância estatística (P = .897). As avaliações nos meses 3, 6 e 12 não revelaram diferenças de significância estatística (P = .293, .237, e .061, em respectivo). Aos 24 meses, as pontuações médias foram 85,15 ± 9,879 no grupo controle e 84,78 ± 14,048 no grupo PRP, sem diferença significativa (P = .498). Os dados correspondentes são descritos na Tabela 4. O teste de Friedman revelou que ambos os grupos exibiram melhoras significativas durante o pós-operatório (P < .001).
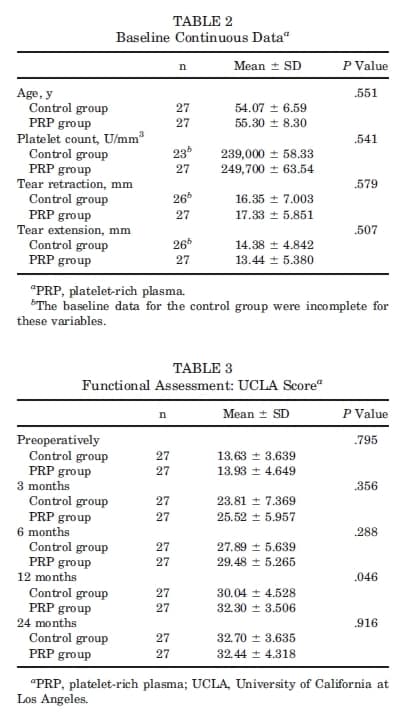
Tabela 2 e 3
Pontuação VAS: O VAS pré-operatório médio foi de 7,00 ± 1,939 no grupo controle e de 6,67 ± 1;617 no grupo PRP, sem diferenças significativas (P = .499). A avaliação durante o período pós-operatório inicial (dias 1 e 7) não revelou diferenças significativas entre os grupos (P = .710 e .588, respectivamente). As avaliações de 3, 6 e 12 meses não revelaram diferenças significativas (P = .791, .657, e .220, respectivamente). Aos 24 meses, a média de pontuação do grupo controle e do grupo PRP foi de 1,15 ± 1,916 e 0,96 ± 2,244, respectivamente; esta diferença não trouxe significância estatística (P = .418). Os dados correspondentes são descritos na Tabela 5. O teste de Friedman indicou que ambos os grupos exibiram melhoras significativas durante o pós-cirúrgico (P < .001).
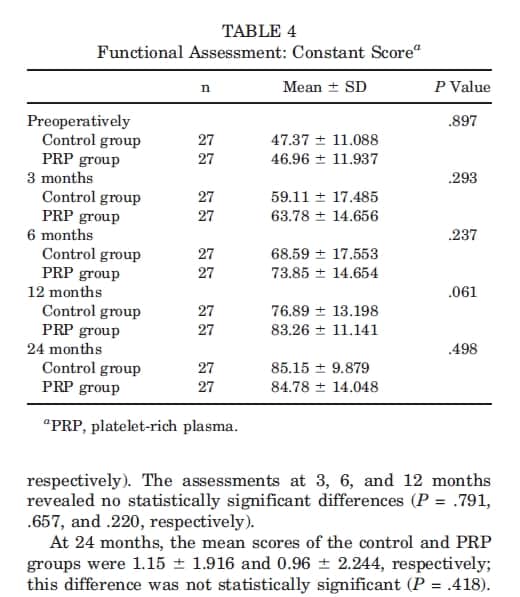
Tabela 4
Avaliação das Imagens de Ressonância Magnética
Características Dos Tendões: Na avaliação de 12 meses, 11,1% dos participantes do grupo controle e 29,6% dos participantes do grupo PRP exibiram sinais normais e densidade suficiente (Sugaya tipo I). A ocorrência de reincidência de lacerações parciais (Sugaya tipo III) foi 4 vezes superior no grupo cotrole na avaliação de 3 meses e 2 vezes superior nas avaliações de 6 e 12 meses em comparação com o grupo PRP. Esta variável não apresentou diferenças de significância estatística entre os grupos em qualquer ponto temporal investigado (Tabela 6).
Reincidência: Apenas 1 caso de ruptura completa pós-cirurgia ocorreu no grupo controle. Esta diferença não foi de significância estatística (p> .999). Realizamos mais análises e adicionamos os casos com rupturas completas e parciais para determinar a reincidência global. Assim, 8 casos foram identificados no grupo controle e 3 no grupo PRP durante a avaliação de 3 meses (P = .175), 5 casos foram identificados em ambos os grupos aos 6 meses, e mais 2 casos aos 12 meses (P = .420) (Tabela 7).
Complicações
Dois casos apresentaram rigidez pós-operatória, 1 de cada grupo, e nenhum demandou um segundo procedimento cirúrgico. Esta variável não exibiu diferenças de significância estatística entre os grupos (P > .999).
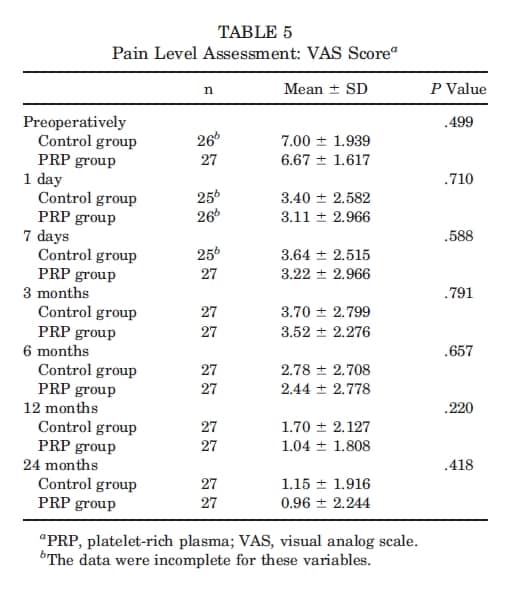
Tabela 5
DISCUSSÃO
O nosso estudo não identificou resultados funcionais significativamente superiores no grupo PRP, medidos por qualquer uma das pontuações aos 24 meses. A única diferença clínica foi na pontuação UCLA após 12 meses (P = .046). Randelli et al., analisando pacientes com lacerações de pequeno e médio porte, encontraram melhores resultados funcionais na pontuação de Constant nos meses 3 e 12, mas nenhuma diferença aos 24 meses. Nosso estudo mostrou achados semelhantes, com melhores resultados no grupo PRP aos 12 meses e nenhuma diferença na última revisão. Outros estudos não encontraram diferenças funcionais entre os grupos, nem demonstraram melhores resultados no grupo controle. Não observamos qualquer efeito do PRP na dor pós-operatória. O estudo de Randelli et al. foi o único que observou melhores resultados analisando a redução da dor como desfecho esperado para o uso de PRP. Gumina et al. descobriram que o uso de PRP levou a resultados piores. Os outros estudos, inclusive 2 metanálises, não mostraram diferenças entre os grupos, ou não avaliaram a dor como resultado. Não há consenso na literatura quanto ao efeito do PRP na integridade anatômica após o reparo do manguito rotador. Gumina et al., Barber et al., e Jo et al. encontraram uma incidência bem menor de reincidência vistas em ressonância magnética nos pacientes tratados com PRP. Em duas das revisões sistemáticas com metanálise, Chahal et al. e Zhang et al. não relataram diferenças entre grupos.
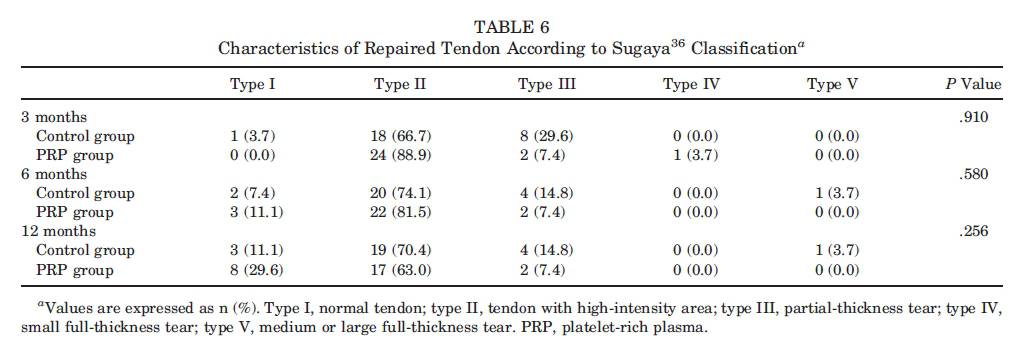
Tabela 6
No entanto, uma análise de subgrupo limitada a lesões de pequeno e médio porte detectadas por RM indicou uma taxa de reincidência um tanto quanto mais baixa no grupo tratado com PRP, em ambos os estudos. Rodeo et al. são os únicos autores que relataram resultados significativamente mais pobres após a aplicação do PRP. No entanto, eles usaram imagens de ultrassom como o método de escolha. O restante dos estudos comparativos não encontrou diferenças entre os grupos. Nosso estudo identificou uma menor percentagem de reincidência no grupo PRP em comparação com o grupo controle (7,4% vs 18,5%, respectivamente), que, no entanto, não foi de significância estatística (P = .420). Os resultados do presente estudo que não foram estatisticamente significativos podem ser atribuídos a erros do tipo II porque o cálculo da dimensão da amostra não levou em conta os desfechos secundários. A detecção de diferenças na análise de dados de natureza categórica necessita de uma amostra maior.
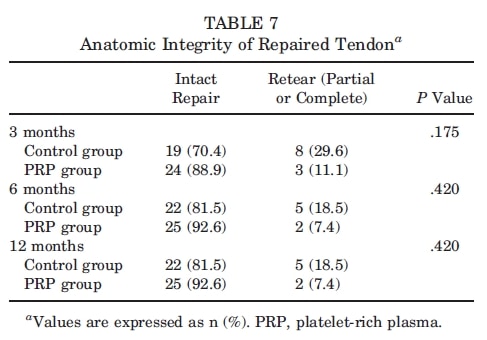
Tabela 7
Existem dois métodos principais disponíveis para preparar o PRP: aférese e centrifugação. O primeiro produz concentrações de plaquetas significativamente maiores, enquanto o segundo é mais prático e menos caro. Não existe consenso sobre a melhor forma de se obter concentração de plaquetas e nenhum estudo clínico comparativo foi conduzido. Weirich et al., embora usando um modelo de regeneração óssea e não um de tendão, descobriram que 1.000.000 de plaquetas/mm³ é a concentração ideal, com quantidades mais elevadas levando a piores resultados. Jo et al., num estudo in vitro com tenócitos, demonstrou que valores entre 4.000.000 e 8.000.000 de plaquetas/mm³ proporciona uma maior proliferação celular.
No que diz respeito à utilização da trombina para ativar a cascata de coagulação, existem argumentos que a apoiam e a desacreditam, não tendo sido realizado qualquer estudo comparativo sobre o seu efeito no ser humano. Virchenko et al., num estudo biomecânico em tendões calcâneos de ratos, demonstraram que a utilização da trombina conduz a uma resistência mais elevada. Scherer et al., estudando defeitos da pele em ratos, mostrou que o PRP sem trombina obteve melhores resultados. Até agora, 3 estudos utilizaram PRP ativado por trombina na reparação do manguito rotador. A concentração ideal de leucócitos é controversa. Dragoo et al., descobriram que a PRP rica em leucócitos levou a uma resposta inflamatória, mas o efeito real desta concentração em resultados clínicos ainda é desconhecido. Três estudos utilizaram PRP rico em leucócitos, com melhores resultados, piores resultados, ou nenhuma diferença no grupo PRP.
No presente estudo, optamos por utilizar PRP preparado por aférese com a adição de trombina. Este método foi usado em um estudo randomizado anterior que avaliou a regeneração da área doadora do ligamento patelar e relatou resultados favoráveis, assim como outro que analisou uma série de casos de reparo do manguito rotador em que nenhum caso apresentou reincidência da lesão. O método de aplicação foi descrito por Randelli et al., e segundo eles, o PRP líquido foi injetado na interface tendão-osso após a cirurgia reparadora ser concluída e o fluido artroscópico remanescente aspirado. Como crítica desfavorável ao método de aplicação PRP utilizado em nosso estudo, podemos dizer que o PRP não permanece apenas no local de reparo do manguito rotador, mas se estende por todo o espaço subacromial, o que não ocorre quando o PRP é usado em estado sólido. No entanto, o método que usamos possui vantagens após as suturas serem feitas e o excesso de solução salina normal for removido desse espaço. A aplicação de PRP sólido durante a fase de sutura requer o fluxo contínuo de fluido artroscópico, o que pode resultar em uma perda de fatores de crescimento e na presença de fragmentos de coágulos.
A taxa global de reincidência em nosso estudo foi de 1,9% (1/54 participantes), com 0% no grupo PRP e 3,7% no grupo controle. Estes valores são inferiores aos relatados por outros autores, que variaram de 8% a 94%. Nosso estudo incluiu apenas lesões de pequeno e médio porte, e esta pode ser a explicação. Outra possibilidade é que usamos ressonância magnética, em vez de artrorressonância magnética, que tem maior precisão na detecção de lesões. Castricini et al. relataram uma taxa global de 6,4% em uma amostra muito semelhante à nossa em relação ao tamanho das lacerações, com 2,5% no grupo PRP e 10,5% no grupo controle.
Observou-se melhora funcional significativa após o reparo artroscópico do manguito rotador em ambos os grupos estudados. Estes resultados estão em concordância com os relatados por outros autores. Vale a pena mencionar que a utilização do PRP em lesões de pequeno e médio porte tem sido alvo de críticas. Theodoropoulos acredita que tais lesões têm resultados clínicos e estruturais satisfatórios na maioria das vezes, sugerindo que as chances de encontrar diferenças de significância estatística são limitadas. De acordo com este autor, deve-se ter foco em lesões grandes e maciças, que exibam um maior risco de recorrência. No entanto, dos 6 estudos que relataram melhores resultados com o uso do PRP, em 3 deles esses resultados correspondiam exclusivamente ao subgrupo de lesões de pequeno e médio porte.
O total de participantes no presente estudo pode parecer pequeno. No entanto, a homogeneidade resultante da inclusão apenas de lesões pequenas e médias, e da exclusão de lacerações subescapulares com o consequente aumento da validade interna permitiu uma redução do tamanho da amostra. Ainda, o fato de o número de plaquetas e leucócitos na PRP não ter sido contado pode ser passível de crítica. Contudo, o método utilizado para preparar o PRP no presente estudo já demonstrou gerar concentrações superiores a 1.000.000 de plaquetas/mm³ e reduzir os níveis de leucócitos em comparação com os valores base.
Não obstante, entre os estudos publicados sobre o uso do PRP na reparação do manguito rotador, apenas 221 incluíram essa medição. Houve mais procedimentos de tenodese no grupo PRP e mais procedimentos de tenotomia no grupo controle. Devido ao pequeno número de participantes totais, não foi possível realizar análise de subgrupos. Outra limitação é que não era possível que o cirurgião fosse alheio ao procedimento, mas pudemos garantir que os pacientes e o avaliador do resultado fossem.
Em conclusão, o PRP preparado por aférese e aplicado no estado líquido com trombina não induziu melhores resultados funcionais ao fim dos 24 meses de acompanhamento pós-reparação artroscópica do manguito rotador no caso de lacerações pequenas e médias. A taxa de reincidência não foi influenciada pelo uso de concentrado de plaquetas, dado o número disponível para análise.
Referências
- Almeida AM, Demange MK, Sobrado MF, Rodrigues MB, Pedrinelli A, Hernandez AJ. Patellar tendon healing with platelet-rich plasma: a prospective randomized controlled trial. Am J Sports Med. 2012;40(6):1282-1288.
- Antun˜ a S, Barco R, Martı´nez Diez JM, Sa´ nchez Ma´ rquez JM. Platelet-rich fibrin in arthroscopic repair of massive rotator cuff tears: a prospective randomized pilot clinical trial. Acta Orthop Belg. 2013;79(1):25-30.
- Barber FA, Hrnack SA, Snyder SJ, Hapa O. Rotator cuff repair healing influenced by platelet-rich plasma construct augmentation. Arthroscopy. 2011;27(8):1029-1035.
- Bergeson AG, Tashjian RZ, Greis PE, Crim J, Stoddard GJ, Burks RT. Effects of platelet-rich fibrin matrix on repair integrity of at-risk rotator cuff tears. Am J Sports Med. 2012;40(2):286-293.
- Boileau P, Brassart N, Watkinson DJ, Carles M, Hatzidakis AM, Krishnan SG. Arthroscopic repair of full-thickness tears of the supraspinatus: does the tendon really heal? J Bone Joint Surg Am. 2005;87(6):1229-1240.
- Burkhart SS, Lo IKY. Arthroscopic rotator cuff repair. J Am Acad Orthop Surg. 2006;14(6):333-346.
- Burks RT, Crim J, Brown N, Fink B, Greis PE. A prospective randomized clinical trial comparing arthroscopic single- and double-row rotator cuff repair: magnetic resonance imaging and early clinical evaluation. Am J Sports Med. 2009;37(4):674-682.
- Castricini R, Longo UG, De Benedetto M, et al. Platelet-rich plasma augmentation for arthroscopic rotator cuff repair: a randomized controlled trial. Am J Sports Med. 2011;39(2):258-265.
- Chahal J, Van Thiel GS, Mall N, et al. The role of platelet-rich plasma in arthroscopic rotator cuff repair: a systematic review with quantitative synthesis. Arthroscopy. 2012;28(11):1718-1727.
- Charousset C, Zaoui A, Bellaı¨che L, Piterman M. Does autologous leukocyte-platelet-rich plasma improve tendon healing in arthroscopic repair of large or massive rotator cuff tears? Arthroscopy. 2014;30(4):428-435.
- Cole BJ, McCarty LP, Kang RW, Alford W, Lewis PB, Hayden JK. Arthroscopic rotator cuff repair: prospective functional outcome and repair integrity at minimum 2-year follow-up. J Shoulder Elbow Surg. 2007;16(5):579-585.
- de Jesus JO, Parker L, Frangos AJ, Nazarian LN. Accuracy of MRI, MR arthrography, and ultrasound in the diagnosis of rotator cuff tears: a meta-analysis. AJR Am J Roentgenol. 2009;192:1701-1707.
- Dragoo JL, Braun HJ, Durham JL, et al. Comparison of the acute inflammatory response of two commercial platelet-rich plasma systems in healthy rabbit tendons. Am J Sports Med. 2012;40(6):1274- 1281.
- Eppley BL, Woodell JE, Higgins J. Platelet quantification and growth factor analysis from platelet-rich plasma: implications for wound healing. Plast Reconstr Surg. 2004;114(6):1502-1508.
- Everts PA, Hoffmann J, Weibrich G, et al. Differences in platelet growth factor release and leucocyte kinetics during autologous platelet gel formation. Transfus Med. 2006;16(5):363-368.
- Fuchs B, Weishaupt D, Zanetti M, Hodler J, Gerber C. Fatty degeneration of the muscles of the rotator cuff: assessment by computed tomography versus magnetic resonance imaging. J Shoulder Elbow Surg. 1999;8:599-605.
- Galatz LM, Ball CM, Teefey SA, Middleton WD, Yamaguchi K. The outcome and repair integrity of completely arthroscopically repaired large and massive rotator cuff tears. J Bone Joint Surg Am. 2004;86(2):219-224.
- Gamradt SC, Rodeo SA, Warren RF. Platelet rich plasma in rotator cuff repair. Tech Orthop. 2007;22(1):26-33.
- Gulotta LV, Rodeo SA. Growth factors for rotator cuff repair. Clin Sport Med. 2009;28(1):13-23.
- Gumina S, Campagna V, Ferrazza G, et al. Use of platelet-leukocyte membrane in arthroscopic repair of large rotator cuff tears. J Bone Joint Surg Am. 2012;94(15):1345-1352.
- Jo CH, Kim JE, Yoon KS, et al. Does platelet-rich plasma accelerate recovery after rotator cuff repair? A prospective cohort study. Am J Sports Med. 2011;39(10):2082-2090.
- Jo CH, Kim JE, Yoon KS, Shin S. Platelet-rich plasma stimulates cell proliferation and enhances matrix gene expression and synthesis in tenocytes from human rotator cuff tendons with degenerative tears. Am J Sports Med. 2012;40(5):1035-1045. Vol. 42, No. 10, 2014 PRP in Rotator Cuff Repair 2453
- Jo CH, Shin JS, Lee YG, et al. Platelet-rich plasma for arthroscopic repair of large to massive rotator cuff tears: a randomized, singleblind, parallel-group trial. Am J Sports Med. 2013;41(10):2240-2248.
- Lafosse L, Brzoska R, Toussaint B, Gobezie R. The outcome and structural integrity of arthroscopic rotator cuff repair with use of the double-row suture anchor technique: surgical technique. J Bone Joint Surg Am. 2007;89(7):275-286.
- Landesberg R, Roy M, Glickman RS. Quantification of growth factor levels using a simplified method of platelet-rich plasma gel preparation. J Oral Maxillofac Surg. 2000;58(3):297-300.
- Malavolta EA, Gracitelli MEC, Sunada EE, et al. Platelet-rich plasma in arthroscopic repairs of complete tears of the rotator cuff. Rev Bras Ortop. 2012;47(6):741-747.
- Marx RE. Platelet-rich plasma (PRP): what is PRP and what is not PRP? Implant Dentistry. 2001;10(4):225-228.
- 28. Marx RE, Carlson ER, Eichstaedt RM, Schimmele SR, Strauss JE, Georgeff KR. Platelet-rich plasma: growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998;85(6):638-646.
- O’Neill EM, Zalewski WM, Eaton LJ, et al. Autologous platelet-rich plasma isolated using the Haemonetics cell saver 5 and Haemonetics MCS1 for the preparation of platelet gel. Vox Sang. 2001;81(3):172-175.
- Randelli P, Arrigoni P, Ragone V, Aliprandi A, Cabitza P. Platelet rich plasma in arthroscopic rotator cuff repair: a prospective RCT study, 2-year follow-up. J Shoulder Elbow Surg. 2011;20(4):518-528.
- Randelli PS, Arrigoni P, Cabitza P, Volpi P, Maffulli N. Autologous platelet rich plasma for arthroscopic rotator cuff repair: a pilot study. Disabil Rehabil. 2008;30(20-22):1584-1589.
- Rodeo SA. Biologic augmentation of rotator cuff tendon repair. J Shoulder Elbow Surg. 2007;16(5 Suppl):S191-S197.
- Rodeo SA, Delos D, Williams RJ, Adler RS, Pearle A, Warren RF. The effect of platelet-rich fibrin matrix on rotator cuff tendon healing: a prospective, randomized clinical study. Am J Sports Med. 2012;40(6):1234-1241.
- Ruiz-Moneo P, Molano-Mun˜ oz J, Prieto E, Algorta J. Plasma rich in growth factors in arthroscopic rotator cuff repair: a randomized, double-blind, controlled clinical trial. Arthroscopy. 2013;29(1):2-9.
- Scherer SS, Tobalem M, Vigato E, et al. Nonactivated versus thrombin-activated platelets on wound healing and fibroblast-tomyofibroblast differentiation in vivo and in vitro. Plast Reconstr
Surg. 2012;129(1):46e-54e. - Sugaya H, Maeda K, Matsuki K, Moriishi J. Functional and structural outcome after arthroscopic full-thickness rotator cuff repair: singlerow versus dual-row fixation. Arthroscopy. 2005;21(11):1307-1316.
- Sugaya H, Maeda K, Matsuki K, Moriishi J. Repair integrity and functional outcome after arthroscopic double-row rotator cuff repair: a prospective outcome study. J Bone Joint Surg Am.
2007;89(5):953-960. - Theodoropoulos J. Evidence-based orthopaedics platelet-rich fibrin matrix augmentation did not improve recovery and healing more than nonaugmented rotator cuff repair. J Bone Joint Surg Am. 2011;93(22):2125.
- Virchenko O, Grenega° rd M, Aspenberg P. Independent and additive stimulation of tendon repair by thrombin and platelets. Acta Orthop. 2006;77(6):960-966.
- Weber SC, Kauffman JI, Parise C, Weber SJ, Katz SD. Platelet-rich fibrin matrix in the management of arthroscopic repair of the rotator cuff: a prospective, randomized, double-blinded study. Am J Sports Med. 2013;41(2):263-270.
- Weibrich G, Hansen T, Kleis W, Buch R, Hitzler WE. Effect of platelet concentration in platelet-rich plasma on peri-implant bone regeneration. Bone. 2004;34(4):665-671.
- Weibrich G, Kleis WKG, Hafner G, Hitzler WE. Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 2002;30(2):97-102.
- Weibrich G, Kleis WKG, Hafner G, Hitzler WE, Wagner W. Comparison of platelet, leukocyte, and growth factor levels in point-of-care platelet- enriched plasma, prepared using a modified Curasan kit, with preparations received from a local blood. Clin Oral Impl Res. 2003;14:357-362.
- Whitman H, Berry L, Green DM. Platelet gel: an autologous alternative to fibrin glue with applications in oral and maxillofacial surgery. J Oral Maxillofac Surg. 1997;55:1294-1299.
- Yamamoto A, Takagishi K, Osawa T, et al. Prevalence and risk factors of a rotator cuff tear in the general population. J Shoulder Elbow Surg. 2010;19(1):116-120.
- Zhang Q, Ge H, Zhou J, Cheng B. Are platelet-rich products necessary during the arthroscopic repair of full-thickness rotator cuff tears: a meta-analysis. PLoS One. 2013;8(7):e69731.


Deixe uma resposta
Want to join the discussion?Feel free to contribute!